鬆綁法規 創新中藥漢方百億商機
策劃.採訪.撰文/金麗萍
圖/鄭清影
繪圖/游家梅
落實臺灣中藥廠GMP制度,堪稱中醫藥的大代誌。因為,對外,傳統中藥廠開始以世界語言進行國際對話;對內,民眾享受GMP藥廠帶來用藥安全保障。
只是,一場GMP推動下來,卻是憂喜參半。喜的是,政府的政策奏效,中藥廠雖走過艱辛,卻順利脫胎換骨,練就國際化經營體質,形同取得躋身國際舞台的參賽權。
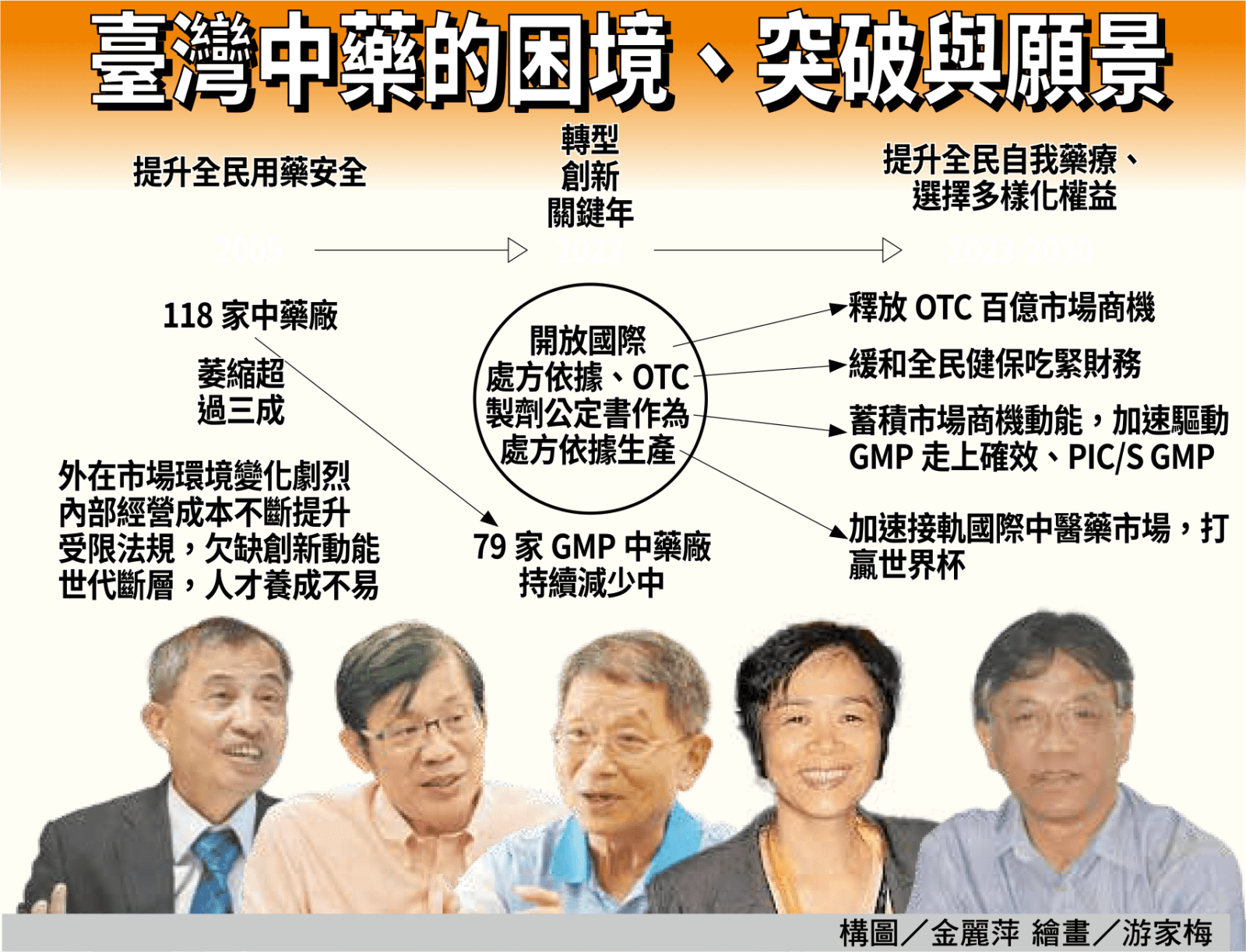
但憂的是:當僅存的79家臺灣GMP中藥廠正準備大顯身手,卻看不到市場未來。濃縮製劑受限於健保總額給付,難見雙贏策略。面對具爆炸性成長潛力的非處方(OTC, Over the Counter)市場,相較於日本,臺灣卻如一攤死水,市場規模新台幣15億元,僅為新台幣200多億元的13分之1;而日本活絡的OTC市場,有一大部份來自於臺灣民眾遠赴日本採買大量漢方OTC藥。
解方為何?產業發展在後,法規鬆綁先行。產業發展與法規環境互為因果的關係,向來是產官學研的共識。只是,在維護全民利益的最高指導原則之下,關鍵之鑰在哪裡?廣開國際處方依據,為臺灣GMP中藥廠創新注入動能,可望為中藥產業打開一條活路。
打造GMP體質 中醫藥大代誌
民國94年,臺灣中藥廠落實推動GMP,堪稱臺灣中醫藥界的大代誌;目的在於提升中藥廠知名度,強化國際連結,增加國際合作、打開海外市場。據衛福部中醫藥司陳昭蓉科長表示,臺灣中藥廠完成落實GMP制度,持續朝向確效努力,確實是一個大躍進;未來,進一步進升至PIC/S GMP,確效是重要的中繼站,類似西藥廠的CGMP制度;而陳昭蓉也認為,對於接軌國際,廠商完成確效後,應已達到八成,離PIC/S GMP已經不遠了。
GMP英雄 卻無市場用武之地?
政府推動PIC/S GMP,打造中藥廠國際競爭體質,立意良善;但面對嚴峻外在生存環境,業者卻是有苦難言,直呼政府對產業困境,少了同理心。臺灣中藥工業同業公會新上任理事長陳如麟持平表示,就提升民眾用藥安全而言,走向PIC/S GMP似乎勢不可擋,可預見業者的經營成本將愈來愈高。只是,對於企業經營效率化而言,業者咬牙苦撐、所走的每一步,都應讓民眾有感於產業的用心,更不應偏廢企業創造獲利的經濟價值。
20年間萎縮超過3成 GMP救不了中藥廠?
從結果來看,GMP似乎救不了臺灣中藥廠。根據資料統計,自民國94年臺灣開始全面實施GMP迄今,已近20年,中藥廠的家數從118家遞減為目前的79家,減幅達三成。
陳如麟直指問題核心:產業看不到未來。產業必須和政府一起勾勒發展願景。所以,政府除了監管,藉由法規鬆綁,釋放商機,對於產業界而言,具有相當高的急迫性。
掌握OTC商機 日本能 臺灣不能?
陳如麟強調,臺灣OTC非處方用藥市場停滯不前,在臺日之間,形成鮮明對比。陳如麟進一步指出,臺日OTC非處方用藥市場規模差距懸殊;日本每年有新台幣200多億元的市場需求,同時,持續保有成長動能,年成長率10%;反觀臺灣,僅15億元,日本足足是我們的13倍。
日本能,臺灣為什麼不能?中醫藥司司長黃怡超認為,臺日制度不同,造成兩方根本的差異。黃怡超強調,在臺灣,中西醫採雙軌制,中西醫之間,涇渭分明;但在日本是為單軌制,基本上,日本沒有中醫師,是由西醫開立漢方藥。
日本活絡的漢方市場,承載著龐大的臺灣OTC非處方用藥需求。據日本國土交通省觀光廳所進行的「訪日外國人消費動向」,以當年4至6月進行統計,臺灣訪日消費遠超過美國、中國、南韓,高居首位,購買金額達1739億日圓,折合新臺幣超過380億元;其中,漢方佔比頗高。
在國際間,日本、韓國、中國大陸以及臺灣等四地,將中草藥視為藥品管理。陳如麟認為,若順利開放日本、韓國、中國大陸等藥典或OTC製劑公定書,作為臺灣處方依據生產;國人可以在自己的國家購買OTC藥品,何必大老遠跑去日本採買?
共識建立 產官學研擬可行性分析
嚴格說來,開放他國處方依據,產官學研已具共識。據衛福部中醫藥司司長黃怡超表示,對於開放他國處方依據,中醫藥司表支持態度,目前也已在中醫藥振興計畫內,納入檢討處方依據及藥品類別管理等內容;未來,將藉由研析其他國家中藥製劑納入藥典的要件等背景資料及藥政管理法規配套,進行可行性探討。
中藥如何揮出紅不讓?
在衛福部中醫藥司長黃怡超看來,臺灣中藥的處境是前有懸崖,後有追兵。所謂懸崖,具有相當難度,但必須面對,就是爭取歐盟和美國的植物證;追兵,則是食品大廠;中藥廠花了極大的心血建立GMP制度,結果,市場卻被食品業者拿去大半。面對前有懸崖,後有追兵,中藥廠必須建立蹲馬步的精神。
黃怡超以臺灣嘉年生化董事長林景寬取得歐盟新藥上市許可為例說明臨床研究的重要性。黃怡超表示,林景寬以鳳梨酵素治療燒燙傷的新藥製程,並於長年處於戰爭狀態的以色列進行臨床;十一年後,終於取得歐盟及美國藥證,建立臺灣植物新藥開發的重大里程碑。
對於臺灣中藥廠多為中小家族型企業而言,黃怡超也認為,大可不必妄自菲薄。他以Schwabe、Bionorica兩家取得歐盟植物新藥的德國藥廠為例說明,這兩家德國藥廠皆非台積電型的大廠,都屬於家族企業;所以,端賴產業界是否願意從蹲馬步開始。
黃怡超表示,所以,中醫藥司對開放他國處方依據雖表支持;但是,對於中藥廠而言,該有的前瞻性臨床研究仍不可免。就像打棒球一樣,你先要有判斷好壞球的能力,才不至於上場就遭三振出局;過程中,必須不斷地練習,才有擊出安打的可能;多一些揮棒安打,才有全壘打的機會。
開放日本處方依據 仍需考量臺日兩地橋接問題
調整不合時宜的相關法規,確實是打造健全傳統中藥發展環境的重要環節。這是中西藥發展的問題。
如何降低檢測成本?目前,國際間推動優良農業規範(GAP),從材料開始進行規範,達到原料端的品質掌握;若兩岸可以據此建立合作,一如日本和大陸所建立的契作合作關係,就有機會減少一百多項藥材檢測的必要性。
臺灣中醫藥發展最大的困境在於:西醫只能用西藥,中醫只能用中藥,和日本不同。日本西醫師只要修足和漢學分,就可以開中藥。
至於,開放日本處方依據仍需考量兩地如何橋接。日本使用中藥,劑量只有台灣的二分之一,甚至更少;日本用藥還有一個特性,他們不做炮製,這是我所了解臺日基本用藥的差異。所以,開放日本處方依據,如果未經炮製,就必須說明炮製前後的成份差異,而成份的變化是否影響藥效,這些都必須備妥資料說明。尤其是劇毒藥物,都是需經炮製過程;如果日本沒有炮製,劑量應降低多少,皆需載明清楚。
中藥廠發展走向正常化,醫藥分業是重要一途。目前,西醫西藥已完成醫藥分業;但中醫中藥還未分業;如果中醫藥分業,那麼,藥品管理將更加精緻。醫藥分業後,對於所謂的處方藥、指示藥。成藥,都需重新整理;而中醫診所進行診斷檢驗,應該像西醫診所一樣,享有健保給付;至於OTC,則無需倚賴健保。這些中醫藥相關議題,實需建立類似國建會的平台,廣納各方建言;對產業而言,不只是監管;更需架構完善的發展環境。
中藥廠市場競爭激烈,原因在藥品差異性不大;事實上,每一間中藥廠應該朝建立招牌藥努力;在此,政府保證專授權,提供誘因,鼓勵廠商投資。鄰近的韓國政府一年投資中藥研究近新台幣50億元,幾乎是我們的100倍;中藥廠確需政府更多關愛眼神。
落實GMP確效 接軌國際法規
臺灣於2005年9月已全面實施中藥GMP,以推進中藥界在國際市場的競爭力。隨著科技進步,GMP與時俱進,內容大幅變動,而PIC/S GMP 是多國採用的標準。為此,衛福部中醫藥司於2018年起公告「中藥優良製造確效作業基準」,並於2020年實施生產濃縮製劑的中藥廠四階段實施確效作業,目的就是要讓中藥廠的品質管理與國際法規接軌,藉以擴增臺灣中藥廠的「國際商機」。
GMP中藥廠生產治病藥品,過程嚴謹;而藥品管理,各國都採屬地管理;如果臺灣藥廠取得中國藥典中的新複方,首先就必須取得授權使用;在臺灣,接著要做這「中藥新複方」的研究實驗包括臨床藥效、安全、化學製造管理等,完成後,就可以申請藥證,製作該新藥。另外,臺灣GMP中藥廠確實有很好的製造品質,已有多家中藥廠接受國外客戶多品項的委託製造,打造臺灣GMP中藥廠走向國際的佳績。
建立中醫藥論壇機制 廣納各方政策建言
因日本、韓國及中國大陸都有中草藥的管理制度,開放這些國家的處方依據,是可深入研究分析,藉此創造雙向銷售效益。一方面藉由臺灣GMP中藥廠生產品質優勢,將所生產的藥品銷往當地國;另一方面,站在民眾的立場,藉由開放他國的處方依據,臺灣中藥廠可以生產相關藥品,造福臺灣民眾。但因為藥品管理的屬地主義,當外銷他國時,就必須符合當地國的法規檢查要求。
藥品管理具有高度嚴謹性,最重要的是有效安全。當論及開放他國的處方依據,就必須考量各國擁有本身的製劑處方,需分析彼此的異同,如何求同存異,從相同之處、低門檻的部份著手,一個處方、一個處方循序推進。
目前,政府和業界溝通的管道應屬暢通,相關會議都有產業代表與會,如召開臺灣中藥典會議時,即有業界的委員代表;各個小組會議也都有業界代表參與。除此之外, 建議設置類似中醫藥論壇機制,將中醫藥相關議題如討論各國處方依據求同存異、如何介接以及產業困境等,納入論壇討論,廣納建言,作為政府政策擬定參考。


